Радиочастотная абляция новообразований
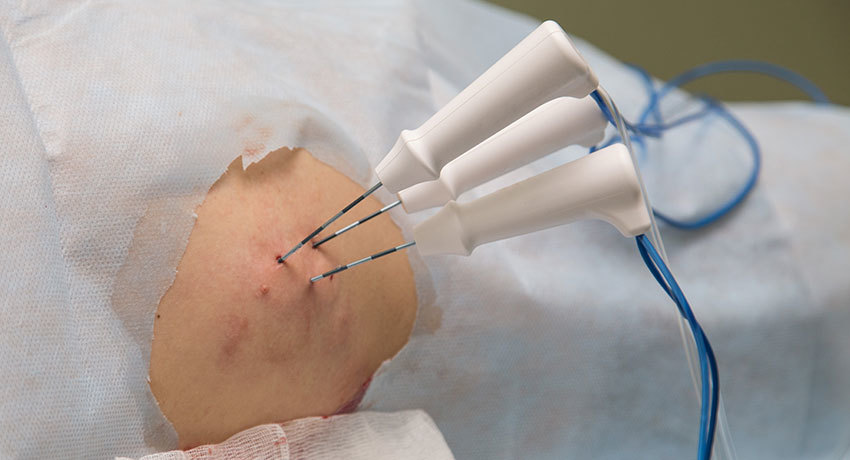
Применение радиочастотной абляции для лечения нарушений ритма сердца началось только в
В
В настоящее время в России не более 10 центров, занимающихся проблемой лечения метастатического рака печени. В основном они располагаются в крупных городах, областных центрах с сильной медицинской школой — Москве,
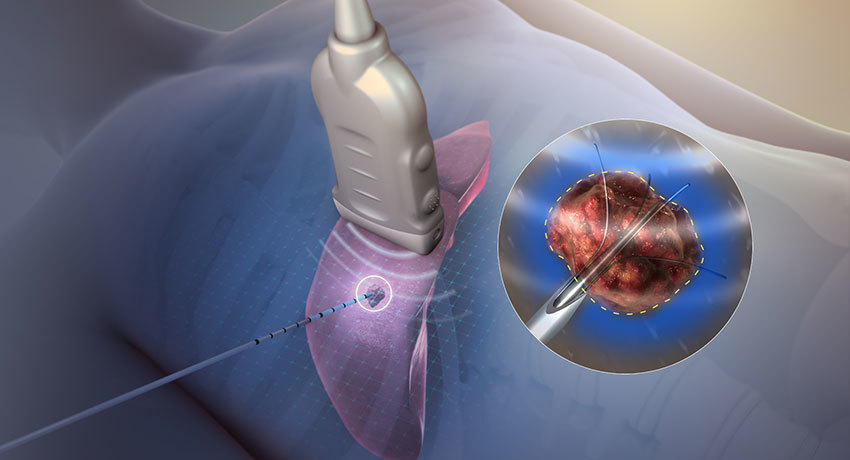
Методика термоабляции новообразований (физические основы абляции тканей)
Основным элементом электрохирургической системы является электрогенератор. Высокочастотный ток передается на электроды. Аппарат нагревает прилегающие к электроду мягкие ткани высокочастотным током специальной формы. В процессе разогрева с периодичностью 2 мс контролируется импеданс тканей. Высокочастотный ток может подаваться однократно или циклически в течение заданного времени. При однократной подаче высокочастотный ток разогревает прилегающие к электроду ткани до температуры (95–110 С) и в момент полного высушивания тканей подача тока автоматически прекращается. При циклической подаче аппарат в течение установленного времени повторяет следующие циклы: подача высокочастотного тока до разогрева (95–110 С) и полного высушивания тканей, выдержка паузы для увлажнения (уменьшения импеданса), возобновление подачи высокочастотного тока. Циклический процесс подачи тока, разогрева и высушивания, повторяющийся многократно, позволяет поддерживать высокую температуру в зоне абляции длительное время и достигать большого объёма коагулированной ткани.
Форма и объём зоны абляции зависят от выбранного электрода и режима работы. Зона абляции делится на три области по степени поражения ткани:
- ближе к электроду расположена область высушивания (дессикации) мягких тканей;
- далее располагается область коагуляции мягких тканей;
- область девитализации располагается вокруг зоны коагуляции.
При увеличении длительности (экспозиции) процедуры абляции общая зона абляции растёт незначительно, однако область дессикации увеличивается.
Показания и противопоказания
Абляцию опухолей применяют в тех случаях, когда невозможно выполнить радикальное оперативное лечение. Это может быть неоперабельность первичной опухоли или сопутствующая патология, которая делает невозможным выполнение радикальной операции в силу её объема и тяжести, но не препятствует выполнению абляции.
Согласно национальным рекомендациям, имеются следующие показания и противопоказания к радиочастотной абляции опухолей печени:
При чрескожном доступе:
- Предшествующее радикальное хирургическое лечение первичной опухоли;
- Отсутствие внепеченочных проявлений заболевания (при колоректальных метастазах);
- Наличие в печени 5 и менее опухолевых узлов (при метастазах нейроэндокринного рака допускается большее количество узлов);
- Диаметр узлов не более 5 см каждый (допустимо подвергать воздействию узлы исходно большего диаметра, но регрессировавшие в объеме под воздействием химиотерапии и других методов лечения);
- Остаточная опухоль после ранее проведенной РЧА либо другого метода лечения;
- Местный рецидив после ранее проведенной РЧА, резекции печени либо другого метода лечения;
- Метахронные метастазы после ранее проведенной РЧА, резекции печени либо другого метода лечения.
Показания к проведению РЧА лапароскопическим доступом:
- Отсутствие выраженных сращений;
- Отсутствие стандартных противопоказаний для всех лапароскопических вмешательств;
- Расположение очага в зонах, доступных лапароскопии;
- Подкапсульное расположение с возможным прилежанием к органам, которые в ходе вмешательства возможно отведением обезопасить от термического воздействия;
- При билобарном поражении печени наличие единичных небольших (до 5 см) узлов в правой доле, в то время как образование левой доли может быть удалено лапароскопически.
Показания к проведению РЧА в ходе открытого вмешательства:
- Билобарное поражение, при котором возможно удалить большую часть пораженной печени и подвергнуть РЧА остающиеся очаги;
- Прилежание к органам брюшной полости и забрюшинного пространства, магистральным сосудам и диафрагме, когда возможно отделение (резекция) этих участков;
- Заранее планируемое сочетанное вмешательство;
- Выраженные сращения, процесс в брюшной полости, особенно после ранее произведенных операциях на печени, когда патологический очаг расположен непосредственно по краю резекции;
- Наличие кроме внутрипеченочного еще и экстраорганного, но удалимого опухолевого узла; общее операбельное состояние пациента; согласие больного на выполнение данного вида лечения.
Противопоказания к проведению РЧА:
- Наличие у пациента искусственного водителя ритма с полиуретановым покрытием электродов;
- Цирроз печени класса «С» (по Чайлду);
- Некоррегируемая коагулопатия;
- Прорастание петли кишки, желчного пузыря, стенки желудка на значительном протяжении;
- Диссеминация опухолевого процесса;
- Общие противопоказания к хирургическому лечению;
- Отказ пациента от выполнения данного вида лечения.
Показания к проведению радиочастотной абляции опухолей легких (по Herrera L.J. et al.):
- Больные НМКРЛ
I–II ст., не подлежащие хирургическому лечению по следующим причинам: сопутствующие заболевания, отказ пациента от хирургического лечения. - Больные, имеющие несколько метастазов в разных долях легких.
- Рецидив опухоли менее чем через 6 месяцев после резекции легкого.
- Диаметр опухоли до 4 см.
- Согласие больного на проведение лечения.
Противопоказания к проведению гипертермической абляции опухолей печени (по
- Расположение опухоли ближе 3 см от прикорневых структур.
- Первичная опухоль не удалена.
- Более 3 метастазов в каждом легком.
- Общее количество метастазов более 5.
- Имеется метастатический плеврит.
Показания к абляции первичного рака почки:
- Пациентов с тяжелой сопутствующей патологией, либо отказавшихся от хирургического лечения.
- Наличие опухолевого узла до 5 см в диаметре (лучшие результаты при РЧА экзофитно расположенных опухолей до 3 см в диаметре).
- Опухоль единственной почки.
Выполнение РЧА чрескожным или лапароскопическим доступом требует соблюдения ряда условий:
При чрескожном доступе:
- Четкая визуализация патологических очагов при УЗИ и КТ/МРТ (в зависимости от способа навигации);
- Возможность достаточно безопасного доступа к опухолевому узлу (достаточная отдаленность от магистральных печеночных сосудов и желчных протоков);
- Отсутствие прорастания (тесного контакта) диафрагмы, почки, желудка, кишки, желчного пузыря;
- Невозможность выполнения оперативного вмешательства в силу соматического состояния;
- Полная обеспеченность возможности экстренной лапаротомии и адекватности традиционного вмешательства;
- Согласие больного на выполнение данного вида лечения;
При лапароскопическом доступе:
- возможность обеспечения достаточно полноценного
УЗ-контроля со стороны брюшной полости; - полная обеспеченность возможности экстренной лапаротомии и адекватности традиционного вмешательства;
- согласие больного на выполнение данного вида лечения.
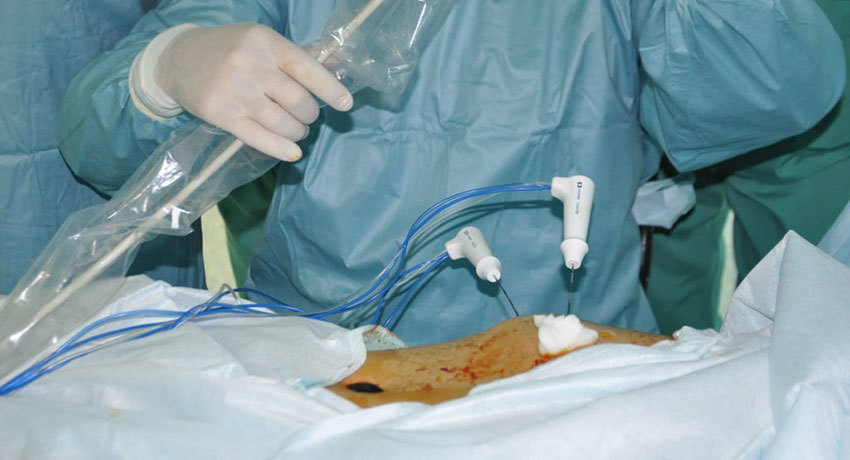
Используемое оборудование и инструментарий
В настоящее время на рынке имеется множество приспособлений для выполнения радиочастотной абляции тканей. Пожалуй, наиболее известным является аппарат Radionics
Эта система комплектуется тремя моделями многозубцовых электродов:
- Starburst XL, Starburst Xli и Starburst Flex. Starburst XL состоит из канюли 14 G, в которую помещены 9 зубчатых электродов. Когда зубчатые электроды полностью выдвинуты, они принимают конфигурацию «рождественской елки» с максимальным диаметром 5 см. Зубцы также могут быть выдвинуты частично для обработки меньшего объема ткани. В 5 из 9 электродов интегрированы термопары, все из которых активны.
- Starburst Xli также состоит из канюли 14 G с активным наконечником, содержащей 9 зубчатых электродов, которые могут быть развернуты до 7 см в диаметре. Из 9 зубцов в 4 имеются термопары, а 5 — полые активные электроды, через которые вводится физиологический раствор. Предотвращая обугливание в области абляции, вливание физиологического раствора увеличивает тканевую электрическую и тепловую проводимость. Электрод Starburst Flex подобен Starburst XL, за исключением того, что канюля гибкая и имеет наружный диаметр 13 G, что требует применения интродюсера диаметром 11 G. Эта гибкость может быть полезна при использовании СКТ для наведения. Отечественным аналогом является аппарат ЭХВЧ-150-«ФОТЕК».
Доступы для проведения процедуры абляции
На сегодняшний день нет единого мнения о выборе доступа для проведения абляции. Для позиционирования электрода используется чреcкожный доступ под УЗИ, КТ- или
Методики РЧА
Чрескожные методы
Наиболее часто прибегают к чреcкожным методам позиционирования электрода. В качестве метода контроля над движением электрода наиболее часто используется ультразвуковая навигация.
Преимущества ультразвуковых методов заключаются в простоте проведения процедуры, отсутствии вредных воздействий на пациента в виде лучевой нагрузки, контроль над происходящими процессами в реальном времени, возможность визуализации сосудистых структур органа, а также наличие направляющих адаптеров на рукоятке ультразвукового датчика.
При выборе направления движения электрода необходимо учитывать расстояние от кожи до места проведения абляции, наличие на пути электрода полых органов, таких как кишка, желудок, желчный пузырь, крупных сосудов, синусов плевры.
Также необходимо учесть угол, под которым будет осуществляться ультразвуковой контроль, дыхательную экскурсию, что особенно важно при поддиафрагмальном расположении опухолевых узлов. Немаловажным является и расположение опухолевых узлов относительно правой или левой долей печени. Так, при расположении опухоли в левой доли печени наиболее целесообразным будет выбор эпигастральной области в качестве места проведения электрода.
При локализации опухолевого узла в правых сегментах печени более целесообразным представляется установка электродов в межреберьях. В этих случаях необходима четкая визуализация расположения плеврального синуса.
В целом выбор области для проведения чрескожной абляции аналогичен таковому при проведении пункционных биопсий очаговых образований печени.
В ряде случаев выполнение абляции под ультразвуковым наведением может оказаться затруднительным или даже невозможным. Это может быть связано с изоэхогенной структурой опухоли, когда выполнить её четкую визуализацию не представляется возможным, наличием выраженной гиперэхогенной зоны при неоднократном проведении процедуры абляции, а также наличием костей или заполненных газами полых органов на предполагаемом пути установки электрода. В таких случаях для позиционирования электрода можно воспользоваться компьютерной томографией.
Для проведения процедуры необходимо соблюдение ряда условий. Достаточно большие гентри аппарата позволят свободно манипулировать инструментом, сокращение времени и дозы облучения снизят риск, связанный с облучением для пациента и врача, сокращение времени сканирования для эффекта получения изображения в реальном времени. Последний пункт ввиду необходимости удерживать электрод руками в момент проведения сканирования (если отсутствуют специальные держатели) и трудности выполнения техники «быстрого сканирования» следует использовать в особо сложных случаях.
Выделяются 5 этапов абляции:
- Планирование;
- Прицеливание;
- Мониторинг;
- Контроль эффективности;
- Оценка эффективности.
Сначала определяют точку введения электрода путем размещения пациента на столе в наиболее удобном для доступа к опухоли положении, установки стола на уровне среза, выбранного для доступа, и маркировки точки введения электрода.
После установки электрода и его продвижения производят контроль его положения путем последовательного сканирования, при этом дистальная тень позволяет контролировать положение кончика электрода.
В тех случаях, когда опухоль не визуализируется ни при УЗИ, ни при КТ без контрастного усиления, можно выполнить предварительную жировую эмболизацию.
Преимуществом МРТ перед КТ является отсутствие ионизирующего излучения, хорошая контрастность мягких тканей, возможность мультипланарной реконструкции, возможность отображать функциональность и температуру ткани.
Интраоперационные методы.
Лапаротомия или торакотомия, которые выполняют для проведения абляции, имеют ряд преимуществ по сравнению с чрескожными методами. К ним относятся возможность интраоперационной ревизии органов, выполнение ИОУЗИ печени, уточнение распространения опухоли, стадии онкологического процесса, выявления необнаруженных на дооперационном этапе отсевов опухоли.
Кроме того, возможно выполнить освобождение предполагаемой области вмешательства от прилегающих петель кишки, выполнить абляцию на участках, прилегающих к желчному пузырю, куполу диафрагмы, сосудам.
Источник: Журнал «Паллиативная медицина и реабилитация».
Содержание
ПОПУЛЯРНОЕ
