Трижды негативный рак молочной железы – особенности лечения

Рак молочной железы является наиболее часто встречающимся злокачественным заболеванием у женщин и, по данным мировой статистики, достигает 22,9%. Заболеваемость РМЖ неуклонно возрастает, несмотря на снижение смертности от него благодаря внедрению скрининга и эффективной системной химиотерапии [1,2,3].
Трижды негативный РМЖ (ТНРМЖ) составляет около 8–20% всех опухолей молочной железы; встречается чаще у женщин молодого возраста (до 50 лет) до наступления менопаузы, у женщин с ранним менархе, первой беременностью в более раннем возрасте, коротким периодом грудного вскармливания, повышенным индексом массы тела [4,5,6,7].
ТНРМЖ характеризуется отсутствием экспрессии РЭ, РП и
Цель исследования
Анализ непосредственных и отдаленных результатов комплексного лечения больных ТНРМЖ.
Материалы и методы
В исследование было включено 128 больных с операбельным ТНРМЖ со сроком наблюдения 5 лет, находившихся на обследовании и лечении в ГБУЗ ОКД № 1 ДЗМ в период с 2006 по 2008 г. При составлении
По данным гистологического исследования, у пациенток преимущественно встречался инфильтративный протоковый рак — 107 (83,6%).
Инфильтративный дольковый рак был верифицирован — у 14 (10,9%) больных, а инфильтративный
В подавляющем количестве случаев у больных была 3 степень злокачественности опухоли — 69 (53,9%) пациенток. 2 степень злокачественности опухоли — у 56 (43,8%) больных, а 1 степень — у 3 (2,3%) пациенток.
Большинство пациентов, по данным иммуногистохимического исследования, имели высокий индекс пролиферативной активности (
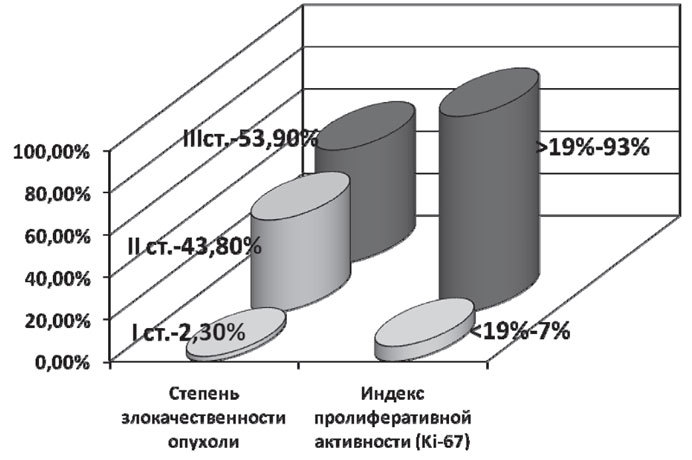 Рис. 1. Частота неблагоприятных признаков у больных с ТНРМЖ
Рис. 1. Частота неблагоприятных признаков у больных с ТНРМЖ
На хирургическом этапе комплексного лечения пациенток с ТНРМЖ были выполнены четыре вида оперативных вмешательств: радикальная резекция молочной железы, радикальная мастэктомия по Мадден, радикальная мастэктомия по Пейти, радикальная мастэктомия по Холстеду.
В 97 случаях (75,8%) из 128 хирургическое лечение было проведено на первом этапе комплексного лечения. Распределение по стадиям этих пациенток представлено на рисунке 2.
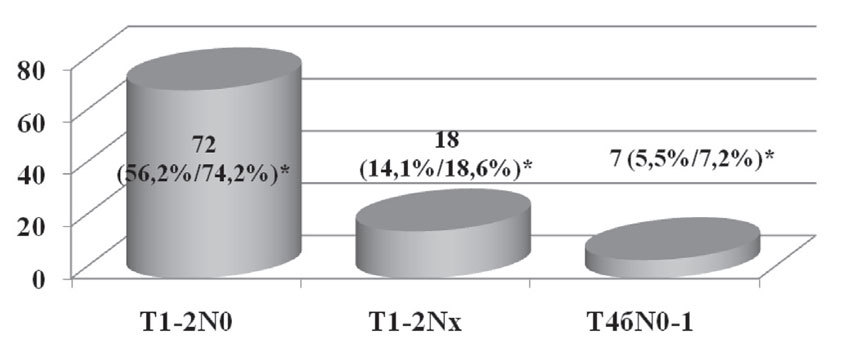 Рис. 2. Пациентки, которым хирургическое лечение было проведено на первом этапе комплексного лечения в зависимости от стадии заболевания
Рис. 2. Пациентки, которым хирургическое лечение было проведено на первом этапе комплексного лечения в зависимости от стадии заболевания
* % от общего числа пациенток / % от числа пациенток, которым проводилось хирургическое лечение не первом этапе
Неоадъювантная химиотерапия как составляющая комплексного лечения была проведена 31 пациентке (24,2%) по следующим показаниям: наличие верифицированных метастазов в регионарные (подмышечные и/или подключичные) лимфоузлы и/или
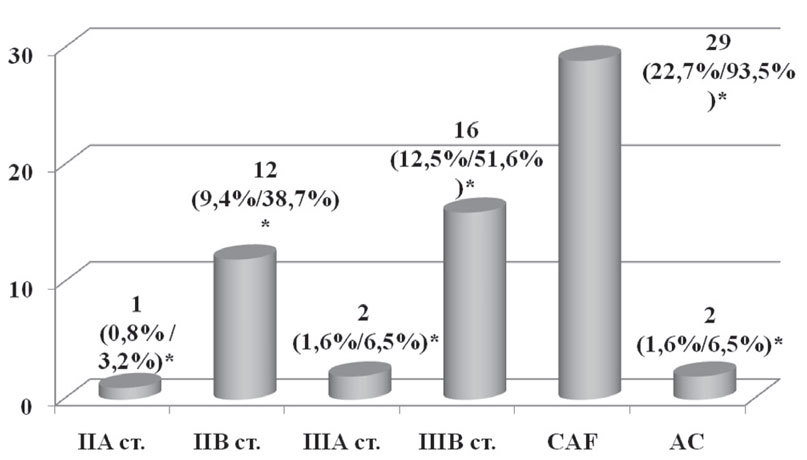 Рис. 3. Неоадъювантная химиотерапия в зависимости от стадии заболевания и схемы химиотерапии
Рис. 3. Неоадъювантная химиотерапия в зависимости от стадии заболевания и схемы химиотерапии
*— % от общего числа пациенток / % от числа пациенток, которым проводилась неоадъювантная химиотерапия
Для проведения неоадъювантной химиотерапии применялись две схемы химиотерапии:
1-я схема — CAF (циклофосфан 600 мг/м2 + доксорубицин 50 мг/м2 +5-фторурацил 600 мг/м2) была применена 29 пациенткам, из них в 28 случаях было проведено 2 курса и 1–3 курса химиотерапии;2-я схема — AC (доксорубицин 50 мг/м2 + циклофосфан 600 мг/м2) была назначена 2 пациенткам, которым было проведено 4 курса химиотерапии.
Адъювантная химиотерапия была проведена 70 (54,7%) пациенткам при различных стадиях заболевания (рис. 4). Применялись 4 схемы адъювантной химиотерапии:
1-я схема — CAF (циклофосфан 600 мг/м2 + доксорубицин 50 мг/м2 +5-фторурацил 600 мг/м2), была проведена 46 пациенткам (65,8%), из них 38 больным (54,3%) было выполнено 4 курса и 8 (11,5%) — 6 курсов химиотерапии;- 2 схема — AC (циклофосфан 600 мг/м2 + доксорубицин 50 мг/м2), была назначена 16 пациенткам (22,8%), из них 11 (15,7%) — 4 курса и 5 (7,1%) — 6 курсов химиотерапии;
3-я схема —5-фторурацил 600 мг/м2 + доксорубицин 50 мг/м2, была применена 5 пациенткам (7,1%), в количестве 4 курсов химиотерапии;4-я схема — абитаксел 175 мг/м2 + доксорубицин 50 мг/м2, была проведена 3 пациенткам (4,3%), в количестве 4 курсов химиотерапии.
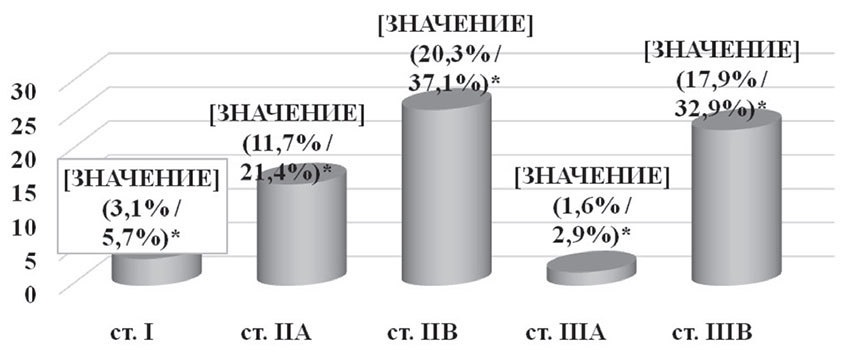 Рис. 4. Адъювантная химиотерапия в зависимости от стадии заболевания
Рис. 4. Адъювантная химиотерапия в зависимости от стадии заболевания
*— % от общего числа пациенток / % от числа пациенток, которым проводилась адъювантная химиотерапия
Лучевая терапия как составляющая комплексного лечения пациенток с ТНРМЖ проводилась как в предоперационном, так и в послеоперационном периоде.
Основными показаниями к назначению лучевой терапии являлись: возможность выполнения органосохраняющего хирургического лечения (радикальная резекция молочной железы); наличие метастазов в 4 и более регионарных (подмышечных и/или подключичных) лимфоузлах, не спаянных между собой; наличие метастатического конгломерата лимфоузлов до начала лечения;
Предоперационная лучевая терапия была проведена 2 пациенткам (1,6% от общего числа).
Одной больной (0,8% от общего числа) с РМЖ стадии II В. — T2N1M0 с целью уменьшения размеров первичной опухоли в суммарной очаговой дозе (СОД) — 20 Гр.
Другой пациентке (0,8% от общего числа) — при РМЖ стадии IIIБ — T4бN2M0 с целью уменьшения отека молочной железы,
Послеоперационная лучевая терапия была проведена 39 пациенткам (30,5%).
Результаты исследования
Проведение комплексного лечения пациенток с ТНРМЖ обусловило необходимость оценки его непосредственных и отдаленных результатов.
При проведении хирургического этапа лечения пациенток с ТНРМЖ нами в послеоперационном периоде был отмечен ряд осложнений, которые были обусловлены прежде всего объемом выполненных оперативных вмешательств. В основном у пациенток были зафиксированы случаи развития лимфостаза верхней конечности — 35 случаев (27,3%); длительной лимфорреи — 18 случаев (14,1%); краевого некроза лоскута (после радикальной мастэктомии), в результате которого заживление послеоперационный раны происходило частично за счет вторичного натяжения — 2 случая (1,6%) (рис. 5).
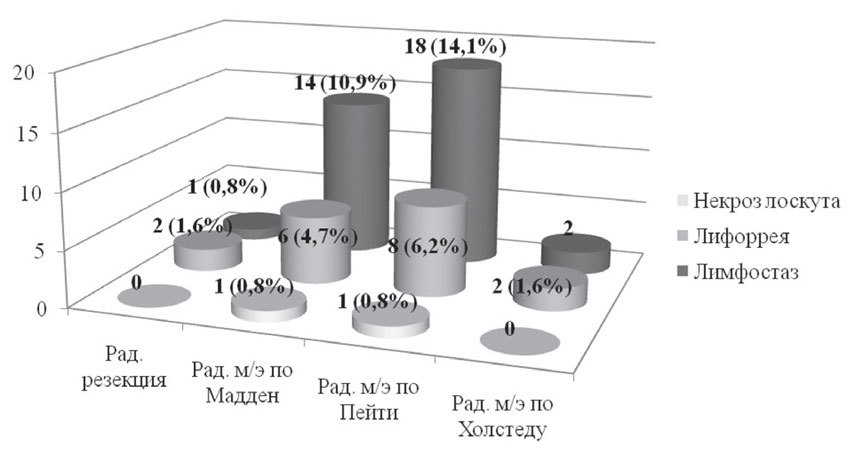
Рис. 5. Характер ранних послеоперационных осложнений в зависимости от вида хирургического вмешательства
Оценка эффективности неоадъювантной химиотерапии проводилась на основании результатов контрольного обследования (маммография и УЗИ молочных желез, подмышечных, над- и подключичных лимфоузлов) и данных о степени лечебного патоморфоза в опухоли, полученных в результате гистологического исследования операционного материала.
У 11 пациенток (35,5%) на фоне проведенной химиотерапии был достигнут полный регресс опухоли (лечебный патоморфоз
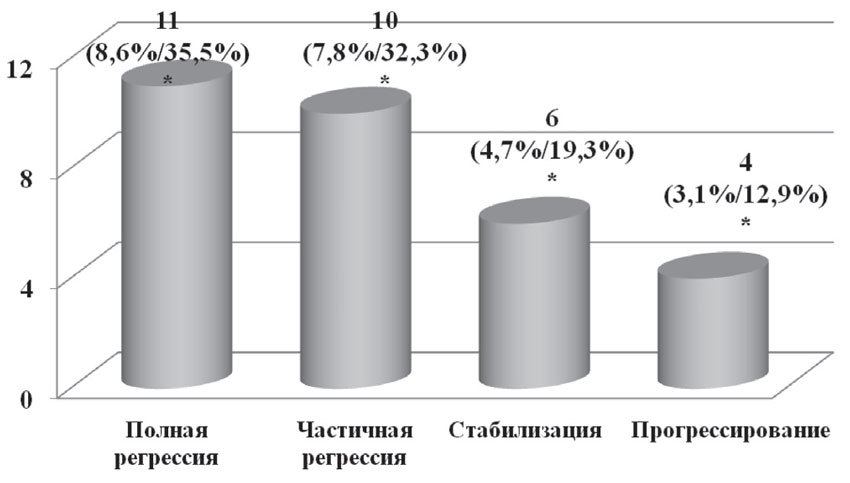 Рис. 6. Данные о лечебном эффекте неоадъювантной химиотерапии
Рис. 6. Данные о лечебном эффекте неоадъювантной химиотерапии
*— % от общего числа пациенток/% от числа пациенток, у которых была выявлена данная степень лечебного патоморфоза опухоли при данной степени заболевания
Помимо оценки эффективности неоадъювантной химиотерапии были проанализированы ее побочные эффекты, которые отмечались у всех (100%) пациенток. Основными проявлениями токсичности были гематологическая токсичность (лейкопения и тромбоцитопения), тошнота, рвота, стоматит,
Аналогичные результаты были получены и при оценке токсичности вышеуказанных схем адъювантной химиотерапии (рис. 7).
В двух случаях проведения предоперационной лучевой терапии был получен хороший лечебный эффект в виде частичной регрессии опухоли. Одной больной была проведена дистанционная гамматерапия в суммарной очаговой дозе 20 Гр по поводу РМЖ IIб ст., второй 25 Гр — IIIб ст.
У 39 пациенток (30,5%) на фоне проведения послеоперационной лучевой терапии отмечались следующие побочные реакции: повреждения кожи I степени были зарегистрированы у 14 больных (11,0%);
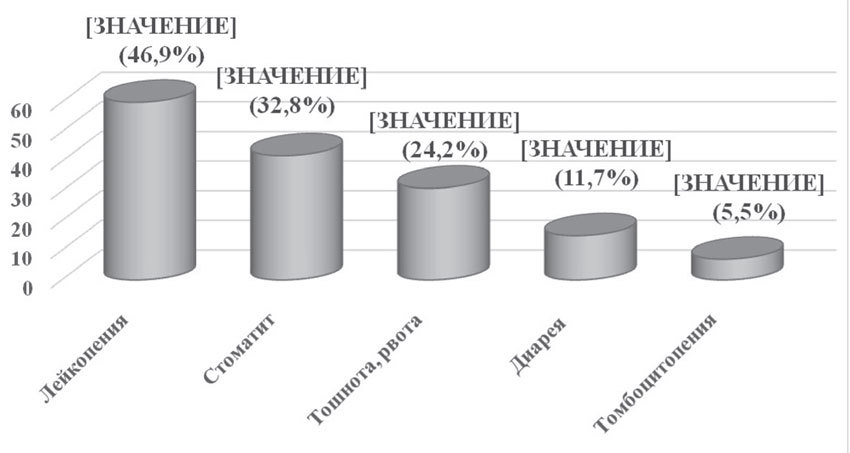 Рис. 7. Токсические реакции изученных режимов неоадъювантной и адъювантной химиотерапии
Рис. 7. Токсические реакции изученных режимов неоадъювантной и адъювантной химиотерапии
С целью оценки отдаленных результатов комплексного лечения пациенток с ТНРМЖ у 128 больных были прослежены сроки появления местных рецидивов и гематогенных метастазов в течение 5–6 лет, а также их локализация. Помимо этого была проведена оценка сроков безрецидивной и общей
Из 128 пациенток у 3 (2,3%) на втором году наблюдения был выявлен локальный рецидив, медиана их появления составила 15 месяцев и 7 дней. Этим больным было проведено комплексное лечение по поводу РМЖ IIIб стадии.
 Рис. 8. Отдаленные результаты комплексного лечения
Рис. 8. Отдаленные результаты комплексного лечения
В результате наблюдения в течение 5 лет у 31 пациентки (24,2%) были диагностированы гематогенные метастазы. Следует отметить, что большая их часть была выявлена на 2–3 годах наблюдения, в среднем — через 23 месяца и 6 дней от начала лечения. Локализация гематогенных метастазов была достаточно разнообразной: в 9 случаях (7,03%) гематогенные метастазы были диагностированы в костях, в 5 случаях (3,91%) — в легких, в 5 случаях (3,91%) — в надключичных лимфоузлах, в 4 случаях (3,13%) — в печени, в 3 случаях (2,34%) — в плевре, по одному случаю (0,78%) — в коже и головном мозге. У 3 пациенток (2,34%) были выявлены сочетанные метастазы: в головной мозг и кости, легкие и кости, кожу и плевру (рис. 9).
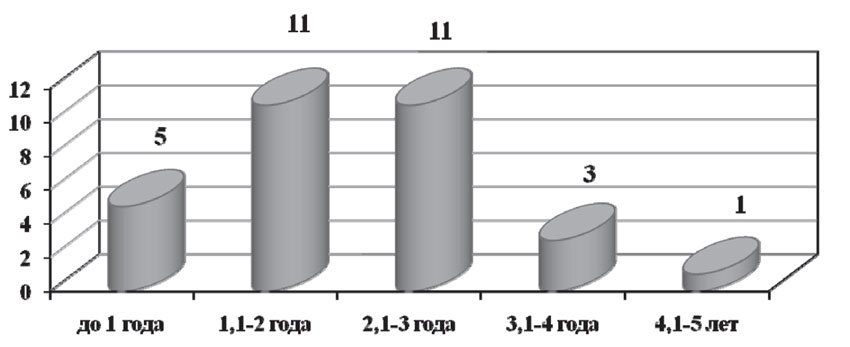 Рис. 9. Число больных с гематогенными метастазами на разных сроках наблюдения
Рис. 9. Число больных с гематогенными метастазами на разных сроках наблюдения
Пятилетняя безрецидивная выживаемость у пациенток, получавших комплексное лечение по поводу ТНРМЖ, составила 75,8%: при I стадии — 28 больных (84,9%), при IIа — 34 пациентки (80,9%), при IIб — 23 случая (82,1%), при IIIа — 2 случая (100%), при IIIб — 10 больных (43,5%) (рис. 10).
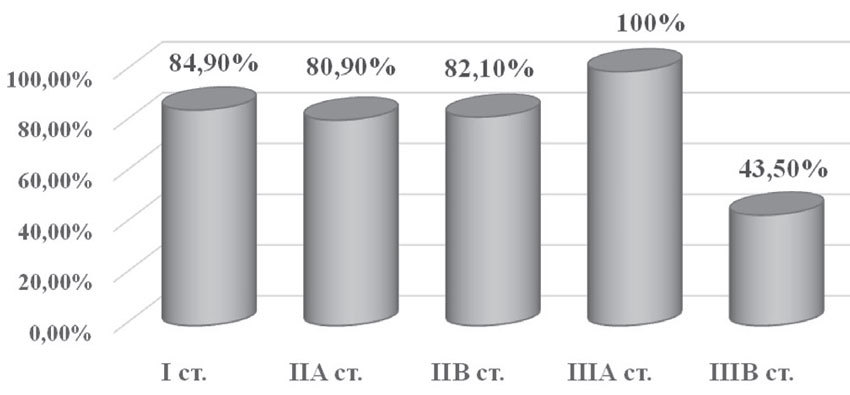
Рис. 10. Пятилетняя безрецидивная выживаемость в зависимости от стадии заболевания
Общая пятилетняя выживаемость составила 77,3%: при I стадии — 28 больных (84,9%), при IIа — 36 пациенток (90,5%), при IIб — 23 случая (82,1%), при IIIа — 2 случая (100%), при IIIб — 10 больных (43,5%). Смерть на первом году наблюдения была зафиксирована у 1 больной (0,8%) (рис. 11).
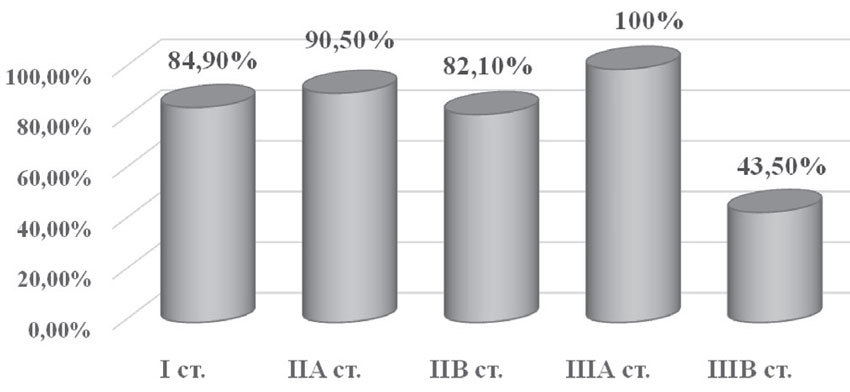 Рис. 11. Общая пятилетняя выживаемость в зависимости от стадии заболевания
Рис. 11. Общая пятилетняя выживаемость в зависимости от стадии заболевания
Заключение
Полученные результаты свидетельствуют о высокой степени эффективности примененных нами способов диагностики и схем комплексного лечения больных с операбельной формой ТНРМЖ.
Литература:
- Химиотерапия при метастатическом раке молочной железы. Маммология. Хирургия молочной железы [Электронный ресурс]. Режим доступа: http://mammalogy.eurodoctor.ru/chemotherapybreastcancer.
- Parkin
D. M. Black -white differences in cancer risk in Harare, Zimbabwe, during 1991–2010. /D. M. Parkin , E. Chokunonga, P. Windridge et al.// Int. J. Cancer. — 2016. — № 138(6). — P.1416–1421. - Audeh W. Novel treatment strategies in
triple-negative breast cancer: specific role of poly (adenosinediphosphate-ribose ) polymerase inhibition. /W. Audeh// Pharmgenomics Pers. Med. — 2014. — № 7. — P.307–316. - Bauer K.R., Brown M., Cress R.D., Parise C.A., Caggiano
v. Descriptive analysis of estrogen receptor (ER)-negative, progesterone receptor (PR)-negative, andHER2-negative invasive breast cancer, theso-called triple-negative phenotype: apopulation-based study from the California cancer Registry. // Cancer. — 2007. — № 9. — р.1721–1728. - Carey
L. A. De -escalating and escalating systemic therapy in triple negativebreast cancer. /L. A. Carey // Breast. — 2017. — № 34(1) — P.112–115. - Carey
L. A. Race , response to chemotherapy, and outcome within clinical breast cancer subtypes. /L. A. Carey ,J. R. Tichy ,A. M. Deal ,C. K. Anders , K.Reeder-Hayes // Breast Cancer Res. Treat. — 2015. — № 150(3). — P.667–74. - Livasy
C. A. Dysregulation of the epigenome intriple-negative breast cancers:basal-like andclaudin-low breast cancers express aberrant DNA hypermethylation. /C. A. Livasy ,J. D. Roll ,A. G. Rivenbark et al.// Exp. Mol. Pathol. — 2013. — № 95(3). — P.276–287. - Mehta
R. S. Clinical outcome oftriple-negative breast cancer with BRCA mutation in the context ofdose-dense and or metronomic chemotherapy. /R. S. Mehta , C. Liu// ASCO Annual Meet. — 2011. — P.1109. - Rakha
E. A. Novel immunohistochemistry-based signatures to predict metastatic site oftriple-negative breast cancers. /E. A. Rakha , S. Klimov,P. C. Rida et al.// Br. J. Cancer. — 2017. — № 117(6). — P.826–834. - Поддубная И.В., Карселадзе А.И., Кулевич
Е. Е. Морфология тройного негативного рака молочной железы // Архив патологии, 2010. — Т. 72, № 2. С. 8–12. - Поддубная
И. В. Клиническая характеристика тройного негативного рака молочной железы // Вестник РОНЦ им.Н. Н. Блохина РАМН. — 2010. — Т. 22, № 1. С. 71–76.
Оригинал опубликован по ссылке
ПОПУЛЯРНОЕ
- Вскрытие паратонзиллярного абсцесса
- Дренирование желчных протоков при механической желтухе
- Осмотр под лампой Вуда
- Оментэктомия (удаление большого сальника)
- Рассечение девственной плевы
- Эпицистостомия
- Аппендэктомия
- Удаление инородного тела из влагалища
- Установка колостомы
- Химиотерапия при раке с метастазами
