Да пребудет с нами сила: собственный иммунитет против рака
За последние десятилетия наука заметно продвинулась вперед в лечении рака, и хотя мы все еще довольно далеки от полной победы над этим страшным заболеванием — у врачей становится все больше инструментов, чтобы разрушать опухоли или ограничивать их рост. Главное — они дают онкологическим пациентам возможность жить все дольше. Один из таких инструментов — это активизация собственного иммунитета человека для борьбы с раковыми клетками. Есть целое направление, посвященное этому — иммуноонкология. На ней сосредоточено очень много внимания, именно в этой области сегодня проводится больше всего исследований и разрабатываются самые многообещающие лекарства.
Мы в международной клинике Медика24 активно используем иммунотерапию — и видим, что она дает хорошие результаты. Правда, сталкиваемся с тем, что многие пациенты вообще не знают о таком методе лечения или считают его еще недостаточно изученным и не заслуживающим доверия. В этой публикации мы постараемся прояснить вопросы: что такое иммунотерапия, как она работает и кому может помочь.
Джуди Перкинс. У неё был рак молочной железы в терминальной стадии, который полностью вылечили с помощью новейшего метода иммунотерапии
Скрытая угроза. Как возникает рак
Раковые клетки — это повстанцы-мутанты, сумевшие перехитрить систему. В процессе жизни все клетки организма проходят строго определенные стадии развития, выполняют заданные функции, размножаются по строгим правилам, а со временем — стареют и умирают. Это естественный процесс. Запрограммированная смерть старых клеток, в которых накопилось много поломок, называется апоптоз.
Однако, под влиянием наследственности или неблагоприятных внешних факторов некоторые клетки накапливают генетические ошибки и «бунтуют»: отказываются жить по заданному природой алгоритму, начинают бесконтрольно размножаться или не умирают в срок. Это не редкость. Потенциально раковые клетки периодически могут появляться в каждом — это нормально. Практически всегда таких «выскочек» убивает служба внутренней безопасности организма — иммунитет.
Но рак стремится выжить и клетки опухоли пытаются захватить как можно больше ресурсов, стать «успешнее». Они размножаются быстрее, выделяют фактор роста сосудов (чтобы привлечь в опухоль больше крови и питательных веществ), развивают устойчивость к лекарствам, вынуждают стволовые клетки усиливать рост опухолевых тканей (посылая обманные сигналы с запросом на регенерацию).
Особых успехов раковые клетки достигают в маскировке: некоторые из них убирают со своей поверхности особые белки-антигены, по которым их могут распознать Т-клетки. Другие выделяют особые молекулы, подавляющие иммунитет, а некоторые даже образуют гибриды с макрофагами (один из видов иммунных клеток) — и приобретают буквально суперспособности!
В этом им помогает, с одной стороны, родство с нормальными клетками организма — некая врожденная маскировка. С другой стороны, генетическая изменчивость раковых клеток дает им повышенную приспособляемость. Чем больше мутаций накопилось в ДНК клетки к моменту ее малигнизации (превращения в злокачественную), тем больше у нее шансов пережить иммунный ответ и выработать успешный план захвата.
Пробуждение силы. История Нобелевских открытий
Человеческий иммунитет — вообще-то настоящая армия безжалостных убийц, и после каждой «боевой операции» по обезвреживанию очередного противника их необходимо успокаивать и переводить из военного в мирное положение. Этот механизм снижает температуру до нормальных значений и прекращает воспаления, когда опасность миновала и заражение побеждено.
Ни один из ученых поначалу не думал о лечении рака. Оба они хотели яснее понять работу иммунного ответа. К тому моменту было ясно, что и на поверхности Т-клеток, и на поверхности антиген-презентирующих клеток (APC) есть рецепторные молекулы, которые и действуют друг на друга, провоцируя или замедляя работу иммунитета. Был открыт TCR — T-клеточный рецептор, которым Т-клетки распознают «вражеские» белки, выставленные на APC. Нашли главный комплекс гистосовместимости MHC (major histocompatibility complex), с помощью которого АРС как раз и преподносят на опознание Т-клеткам кусочки чужеродных белков. Свою Нобелевку за открытие этого сценария получили в 1996 г. Питер Доэрти и Рольф Цинкернагель.
Ученые понимали, что рецепторы на поверхности Т-клеток работают совместно с ко-стимуляторами на поверхности APC. Белок CD28 с поверхности Т-клеток выделили еще в 1980 году, вскоре на поверхности APC нашли молекулу B7. В ходе экспериментов исследователи группы Эллисона перенесли ген B7 в раковые клетки, и те стали отторгаться здоровой тканью. Оказалось, B7 соединяется с CD28 на Т-клетке, и тем самым запускает ее работу: Т-клетка уничтожает клетку опухоли, на поверхности которой «торчит» белок B7.
В 1987 году Эллисон обнаружил цитотоксический T-лимфоцитарный антиген-4 CTLA-4 (cytotoxic T-lymphocyte-associated antigen-4) — и выяснил, что по структуре этот белок похож на давно известный CD28, и тоже способен связываться с B7 — однако при этом действует совершенно обратным образом: останавливает иммунную реакцию.
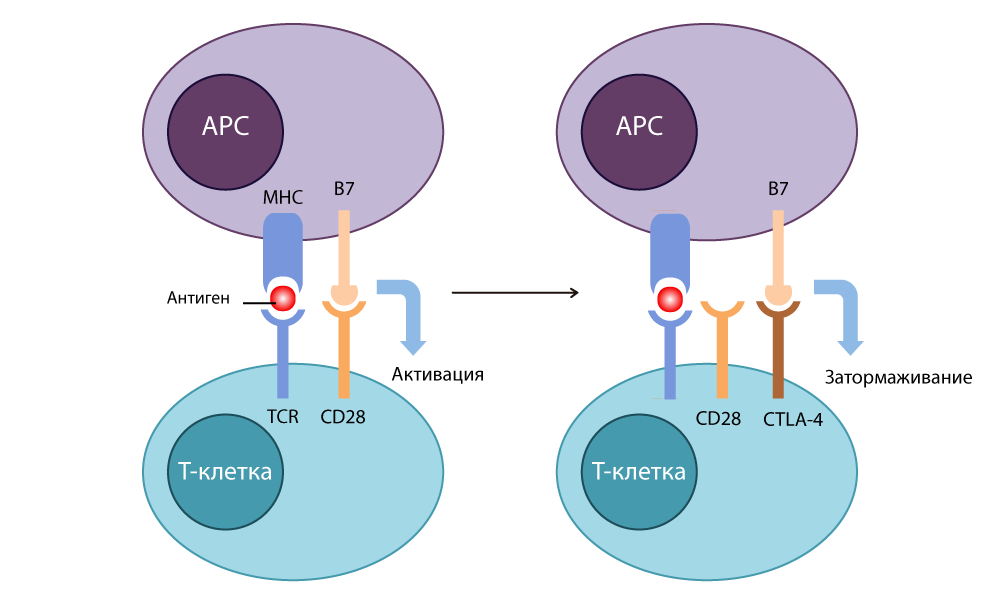
Действие CTLA-4
Сначала медики собирались использовать этот «тормоз», чтобы бороться с аутоиммунными заболеваниями (когда иммунитет начинает атаковать здоровые клетки организма). Но Эллисон придумал гениальную вещь: не давить на тормоз, а отключить его.
Он разработал антитело-ингибитор (выключатель), которое связывалось с CTLA-4 и не давало ему сомкнуться с B7, чтобы отключить иммунные реакции. Свободные молекулы B7 связывались с CD28, Т-клетка активировалась и снова была готова убивать. Когда он в 1995 году провел опыты на больных раком мышах, стало ясно, что от таких Т-лимфоцитов с отключенными тормозами не могут скрыться даже хитрые клетки раковой опухоли. В 2010 уже были проведены успешные исследования на безнадежных больных. У некоторых пациентов исчезла меланома вместе с метастазами — невероятный результат!
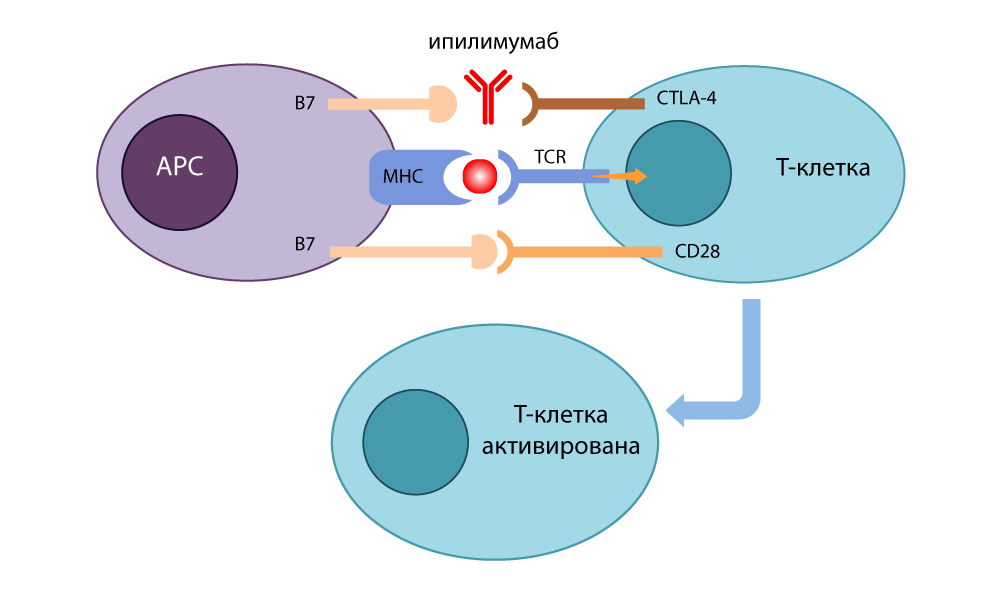
Действие ингибитора CTLA-4 — ипилимумаба
В то же время в Киото Тасуку Хондзё нашел на поверхности Т-клетки другую рецепторную молекулу: PD-1 (Рrogrammed cell Death protein-1, Белок Программируемой клеточной Смерти-1). В ходе экспериментов (снова на многострадальных мышках) японец выяснил, что отключение гена, кодирующего этот белок, провоцирует у мышей симптомы аутоимунного заболевания — то есть ингибирование PD-1 тоже отключало «тормоза» у Т-лимфоцитов и делало их агрессивными и активными.
Хондзё выяснил, что PD-1 переводит Т-клетку в «спящий режим», когда связывается с белком PD-L1/ PD-L2 на поверхности антиген-презентирующей клетки (APC). Ингибитор PD-1 размыкал эту связь и снова активировал Т-клетки. Действие этого «тормоза» было похоже на действие CTLA-4, но проходило другим маршрутом.
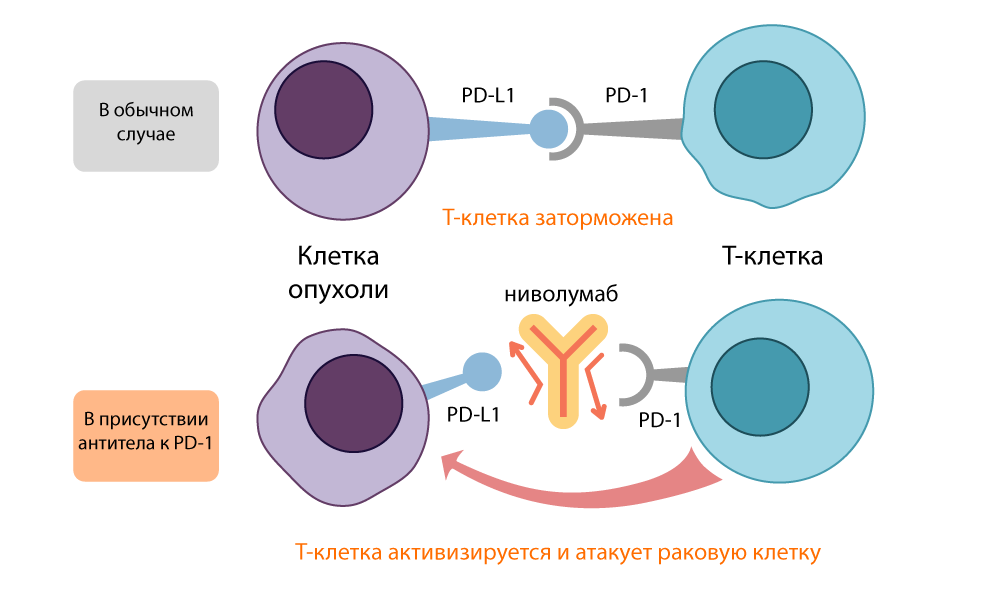
Действие ингибитора PD-L1 — ниволумаба
Обе открытые «тормозящие» молекулы, CTLA-4 и PD-1, назвали иммунными контрольными точками (checkpoints) — именно их количество и активность заставляют Т-клетки принимать решение: успокоиться или начать воевать.
Выяснилось, что блокаторы CTLA-4 активируют иммунитет в общем, все Т-клетки, а ингибитор PD-1 — более специфично действует именно на опухоли, т.к. многие раковые клетки несут на себе «второй кусочек паззла», молекулы PD-L1/ PD-L2. Из-за этого лечение ингибиторами PD-1 дает меньший риск осложнений.
Иммунитет наносит ответный удар. От чего помогают ингибиторы контрольных точек
Эллисон и Хондзё сделали не просто серьезный вклад в понимание физиологических процессов, но и запустили волну принципиально новых практических исследований именно в прикладной медицине.
Открытие ингибирования иммунных контрольных точек (ИИКТ) открывает принципиально новую область поиска решений. Существующие до этого способы борьбы с раком: хирургия, лучевая и химиотерапия — были направлены непосредственно на саму опухоль, на уничтожение раковых клеток. Теперь у медиков есть огромное поле для исследования в совершенно ином направлении: изменение взаимодействия раковых клеток с их окружением.
Кстати, именно это принципиальное отличие дало медикам настоящий прорыв. До сих пор на опухоль действовали в зависимости от ее локализации. Для рака молочной железы один препарат, для рака желудка — совсем другой. А ингибитор ИКТ пембролизумаб в 2017 году был впервые в истории онкологии зарегистрирован как препарат для терапии любого рака в любом органе — если только тесты подтвердят, что опухоль имеет особое свойство: микросателлитную нестабильность. То есть ее ДНК особенно склонна к мутациям. Ранее ни разу не получалось сделать лекарство от рака по какому-то общему признаку. Это большое достижение.
При лечении немелкоклеточного рака легкого ниволумабом (ингибитор PD-1) риск смерти пациентов снизился на 40%.
Препарат пембролизумаб (также ингибитор PD-1) показывал снижение роста опухоли на 43% в группе лечившихся от меланомы. 74% пациентов жили без ухудшения в течение года, в течение 18 месяцев их было 71%. Важно, что эффект от назначения препарата перевешивал побочные эффекты на всех стадиях развития болезни.
Сегодня с помощью препаратов ингибиторов CTLA-4 и PD-1 лечат меланому (в том числе неоперабельную), немелкоклеточный рак легкого, плоскоклеточный рак головы и шеи, почечно-клеточный рак, некоторые виды лимфом, рак прямой кишки, мочевого пузыря, и опухоли с микросателлитной нестабильностью.
Особенное внимание привлекают исследования, которые показывают эффективность комбинированной терапии одновременно анти-PD-1 и анти-CTLA-4 препаратами.
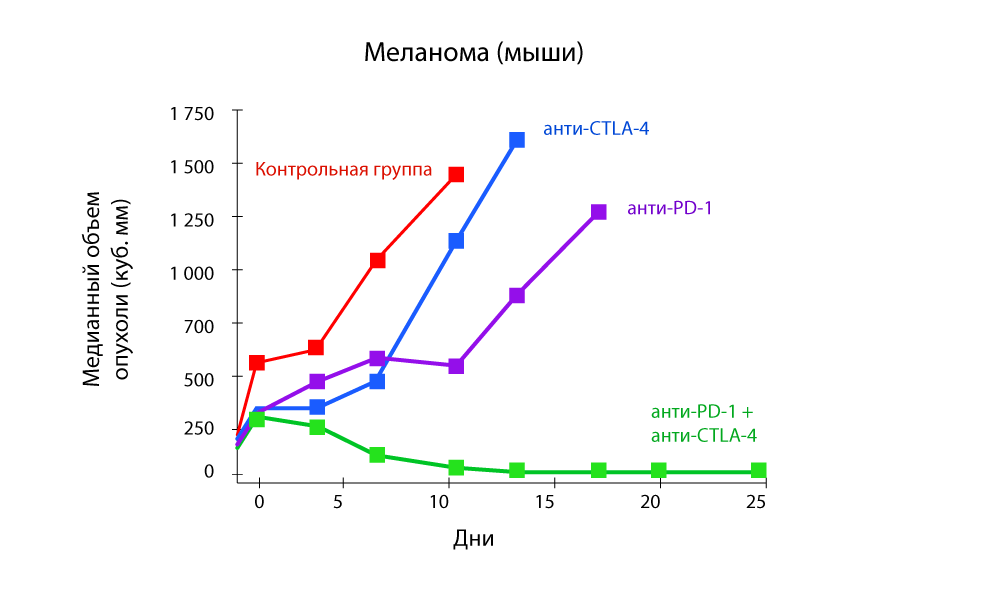
Изменение объема опухоли — резкое снижение при комбинации анти-PD-1 и анти-CTLA-4 препаратов
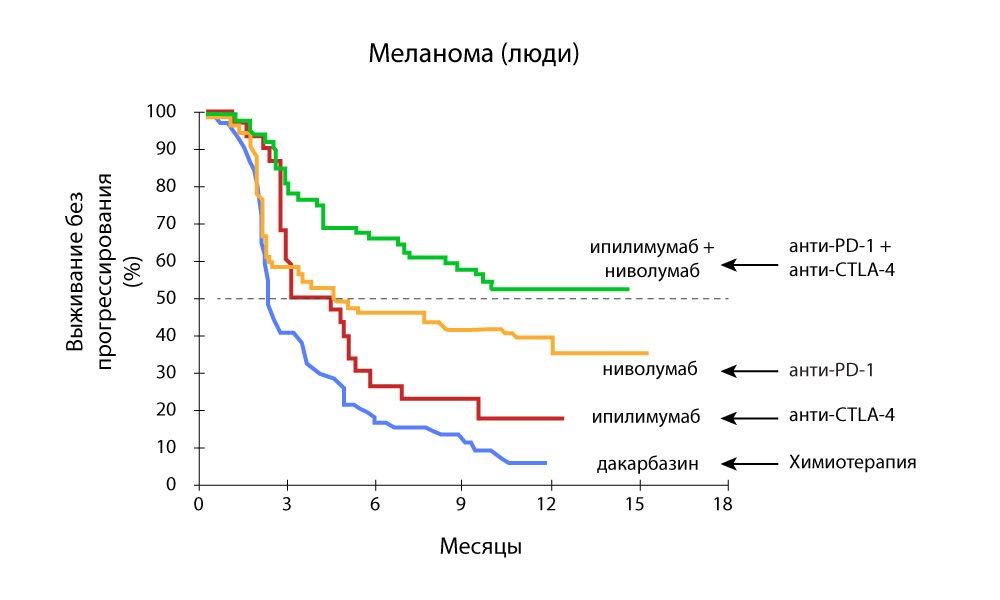
Выживаемость без прогрессирования — комбинация анти-PD-1 и анти-CTLA-4 препаратов более эффективна
В международной клинике Медика24 мы успешно применяем пембролизумаб и ниволумаб с момента их регистрации в РФ. Мы следили за всеми зарубежными исследованиями и очень ждали пополнения арсенала.
Атака клонов. Генетически модифицированный иммунитет
Ингибиторы иммунных контрольных точек заслуженно находятся в центре внимания, но этот механизм пока небезупречен и не может вылечить любой рак. Хорошо, что в иммунотерапии активно развиваются смежные направления исследований. Одно из самых многообещающих — CAR-T терапия.
Буква Т в названии метода — все те же неизменные Т-клетки нашего иммунитета. CAR (Chimeric antigen receptor) — это химерный рецептор антигена. Почему рецептор называют химерным? Потому что он собран из нескольких частей, взятых от разных клеток — с помощью умений генных инженеров.
Правда, не очень точно. Разновидностей TCR у нас куда меньше, чем существует антигенов. Поэтому Т-клетки умеют распознавать своим TCR много антигенов, но — только приблизительно. Раковые клетки часто пользуются этой слабостью нашей системы безопасности и притворяются «своими».
Эволюция решила проблему как умела: в организме человека есть еще один механизм выявления чужаков: антитела. Это особые белки, которые выделяются другим классом иммунных клеток: B-лимфоцитами. У В-клеток, в отличие от Т-клеток, к каждому «клиенту» индивидуальный подход.
Антитело представляет собой белковую структуру в виде буквы Y. На обоих концах этой «вилки» есть участки, связывающиеся с антигеном. Эти участки могут изменяться у каждого следующего поколения антител, чтобы плотнее прилегать к антигену — как подбор кусочков паззла. При обнаружении чужеродного антигена В-клетки выделяют миллиарды антител, среди которых идет отбор на самое точное соответствие антигену. В итоге получаются эталонные антитела, «натасканные» специально для очень точного распознавания конкретного «чужака» — антигена.
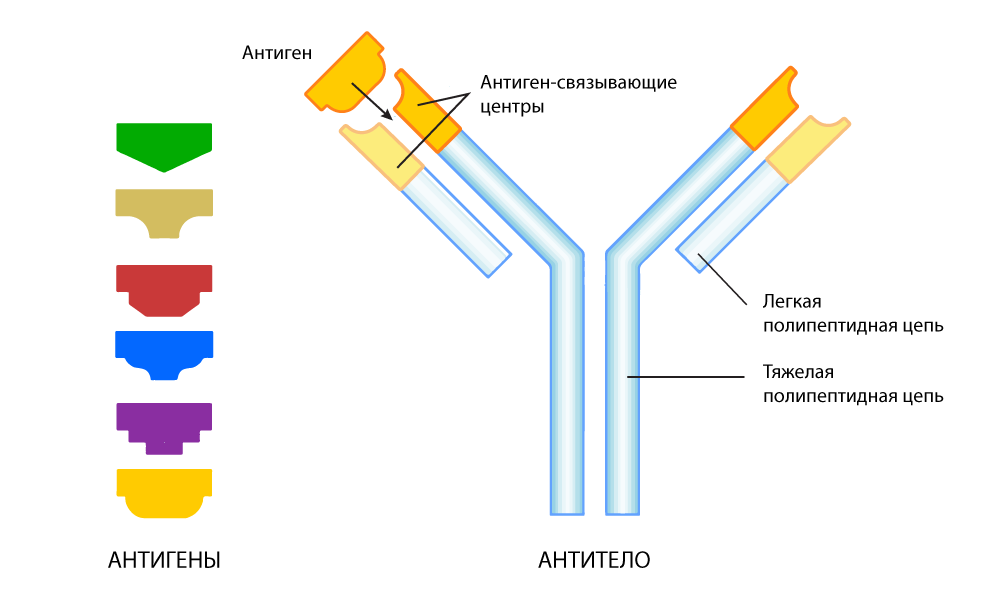
Антитело, приспособленное находить определенный антиген
Однако, распознать — не всегда означает обезвредить. С этим у антител сложности — самостоятельно уничтожить «врага» они могут далеко не во всех случаях.
Так вот, в 1989 году израильский химик и иммунолог Зелиг Эшхар придумал объединить убийственную мощь подслеповатых Т-клеток и снайперское прицеливание антител. Он выделил концевые участки белков-антител, которые способны плотно связываться с антигеном определенных раковых клеток, и «пересадил» их в Т-клетку — заменил ими часть TCR, отвечающие за распознавание антигенов.
Впоследствии он начал работать совместно с американским коллегой, Стивеном Розенбергом, у них получилось сделать химерный рецептор более эффективной конструкции, одновременно чувствительный и избирательный.
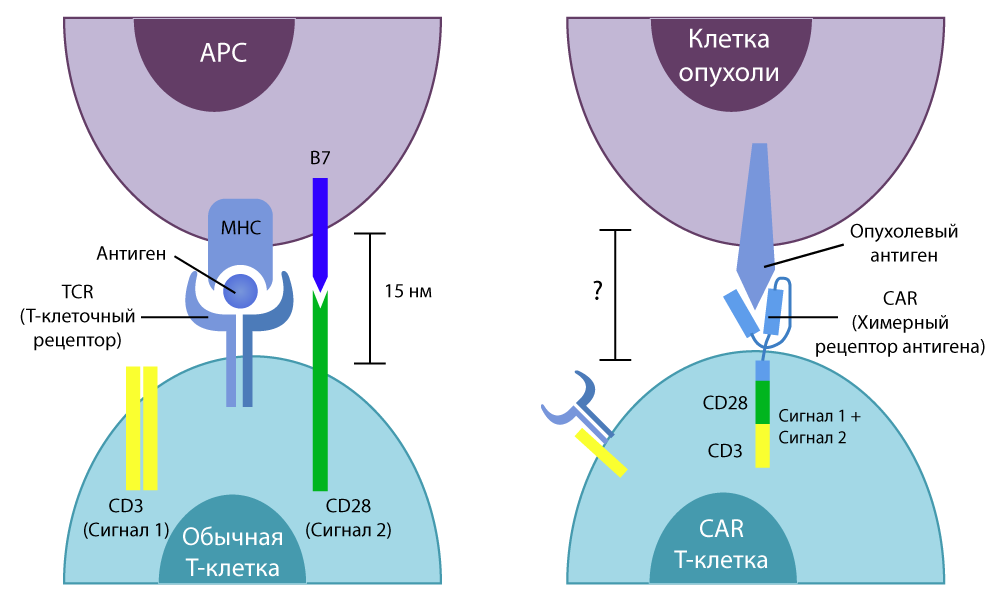
Разница между обычными Т-клетками и CAR-T-клетками
Исследования в пробирке показали хороший результат. Затем ученые снова лечили мышей, затем кропотливо переносили методику на человека.
Со временем терапию CAR-T привели к современному виду.
- Сначала с помощью генно-молекулярного тестирования определяют специфические мутации в опухолевых клетках человека, на которые можно «настроить» антитела.
- Затем у человека берут его собственные Т-клетки, изменяют с помощью биоинженерных методов, вместо TCR «пересаживая» CAR, настроенный на выявленные мутации.
- Затем модифицированные CAR-T клетки размножаются в пробирке и вводятся обратно в организм человека, где они успешно распознают и убивают раковые клетки.
В клинических исследованиях, начатых в 2010 году, сразу получились обнадеживающие результаты: в лечении лимфомы 12 из 13 пациентов показали улучшение, а у 4-х наступила ремиссия. При лечении лейкемии ремиссия наступила у 17 человек из 33.
В 2018 в Nature Medicine появилась статья американских онкологов, где сообщалось, что уже два года они наблюдают пациентку, полностью здоровую после CAR-T терапии. Ее вылечили от метастатического рака молочной железы с метастазами. Это ее фотография в каяке приведена в начале статьи: после лечения она вернулась на работу и ходит в походы.
Новая надежда. Станет ли иммунотерапия панацеей?
Как и у других методов лечения рака, у иммунотерапии есть свои ограничения. Несмотря на то, что в ряде случаев пациенты дают очень хороший ответ на терапию ингибиторами иммунных контрольных точек, в 60% случаев либо развивается приобретенная, либо наблюдается первичная резистентность к анти-PD-1 или анти-CTLA-4 препаратам: опухоль просто не реагирует на лечение или быстро приспосабливается и учится его «обходить».
Кроме PD-1, PD-L1/2, CTLA-4, CD28 и B7 на поверхностях Т-клеток и опухолевых клеток есть масса других ко-рецепторов, действие которых пока не изучено так хорошо, как работа контрольных точек, но они также влияют на иммунный ответ. Одно из направлений работы — влияние на эти ко-рецепторы.
Кроме того, терапия ИИКТ дополняется введением вакцин, цитокинов, бета-блокаторов — и такой подход тоже хорошо работает в ряде случаев.
CAR-T терапия все еще является крайне дорогой и пока еще только переходит в стадию коммерческого использования: ведутся разработки в научных группах Эшхара и Розенберга, других исследователей — каждая из групп создают особые виды CAR-Т с направленным действием против определенного вида рака. Но пока это только исследования, проверки и испытания. Пройдет несколько лет, прежде чем это превратится в отработанный массовый способ лечения — но и тогда нельзя будет давать 100% гарантий.
Если стандартно до сих пор иммунотерапевтические препараты включали в третью, в пятую линию (то есть очередь) терапии, то сейчас врачи движутся к тому, чтобы назначать их сразу, вместе с химиотерапией и терапией таргетными моноклональными антителами: такие пациенты часто показывают более хорошую динамику и в итоге живут дольше.
В России уже зарегистрированы все основные иммунопрепараты. Проблема, правда, что для каждого из них Минздрав отдельно оговаривает показания. То есть в оригинальной инструкции к препарату может быть прописано, например, девять разных видов рака, при котором препарат можно назначать, а у нас в стране он зарегистрирован только для шести из них. И так с каждым препаратом. В итоге, пока около 50% опухолей еще не включены в этот список. Соответственно, в рамках лечения по ОМС врач может выписать эти препараты далеко не всем пациентам.
Ну и частая проблема — отсутствие квалификации. Метод, хоть и успел проявить себя, пока для многих врачей в стране еще новый. Препараты все западные, и доходят до нас с опозданием на 2-3 года. А, учитывая, что активно применяется иммунотерапия всего несколько лет, у многих еще нет опыта работы с ними. Кроме того, использование иммунотерапии требует специфических знаний.
В частной медицине мы не ограничены бюджетом. Если в международную клинику Медика24 обращается пациент с такой опухолью, для которой еще не зарегистрирован препарат иммунотерапии, мы предлагаем ему пройти молекулярно-генетическое исследование. По результатам становится понятно, отреагирует ли его опухоль на иммунопрепарат. Если да — врач имеет полное право ее назначить. Поэтому в нашем стационаре мы применяем иммунотерапию почти по всем видам рака — она дает очень хорошие результаты. Даже пациенты на III-IV стадии показывают улучшения. Иммунопрепараты дают нам возможность продлять людям жизнь, даже в случаях, которые считались безнадежными.
Общее и в частных, и в государственных клиниках — это сами пациенты. Они не всегда хорошо понимают, что это за метод, как он работает, отсюда недоверие. Мы надеемся, эта статья помогла разобраться и понять, что иммунотерапия сегодня совершенно заслуженно находится в фокусе пристального внимания онкологов. Судя по результатам, она уже готова встать на один уровень с классическими методами. Страшная болезнь отступит еще на шаг дальше.
Содержание
ПОПУЛЯРНОЕ
- Вскрытие паратонзиллярного абсцесса
- Дренирование желчных протоков при механической желтухе
- Осмотр под лампой Вуда
- Оментэктомия (удаление большого сальника)
- Рассечение девственной плевы
- Удаление инородного тела из влагалища
- Аппендэктомия
- Эпицистостомия
- Установка колостомы
- Химиотерапия при раке с метастазами
