Клинические исследования. Как попасть в экспериментальную группу, получить бесплатное лечение от рака и помочь науке

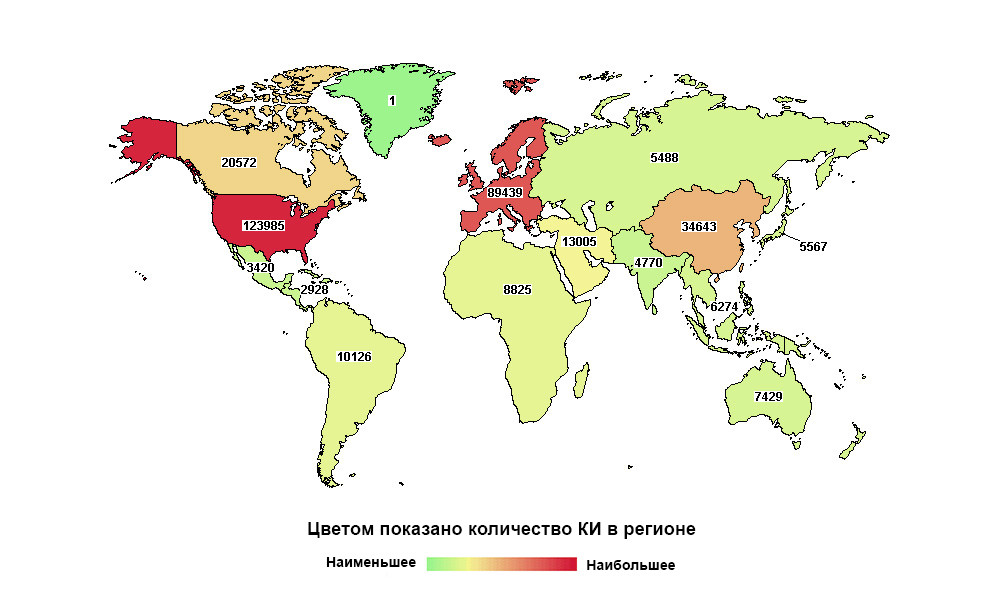
Россия далеко не на первом месте в мире, но первая по количеству исследований в своем макрорегионе
Любое лекарство сегодня, прежде чем попасть к пациенту, проходит длинный ряд клинических испытаний. Нужно доказать, что оно способно решать определенную проблему со здоровьем, причем делать это эффективнее и, желательно, безопаснее предшественников.
Отбор жесткий — 98% из всех исследуемых препаратов не доходит до пациентов. У 2% «счастливчиков» научные изыскания по новому веществу до выхода на рынок занимают более 12 лет и более 1,5 миллиардов долларов.
Мы в международной клинике Медика24 связаны с клиническими исследованиями напрямую. Уже
Для частных клиник практика необычная: минимум коммерческой выгоды, слишком много сложностей в организации процесса и строгие требования к лечебному учреждению. Обычно только крупным федеральным центрам удается им соответствовать.
А ведь для многих пациентов в России клиническое испытание препарата — единственный шанс получить бесплатное лечение от смертельной болезни. Но среди российских онкопациентов 30% просто не знают, что такое клиническое исследование, и лишь немногие принимали в них участие.
Поэтому мы хотим, чтобы как можно больше людей узнали и проверили: возможно, у них есть шанс получить препарат, который может спасти им жизнь.
В этой статье мы расскажем, зачем нужны и как устроены клинические исследования, кто и как может туда попасть.
Грустные истории. Зачем нужны клинические испытания и почему без них — плохо
Клиническое исследование/испытание (далее — КИ) — научное исследование с участием людей в качестве испытуемых, которое проводится с целью оценки эффективности и безопасности нового лекарственного препарата или расширения показаний к применению уже известного. Кроме лекарств, КИ могут также изучать эффективность и безопасность новых методов лечения и диагностики.
Медицина эволюционирует и превращается в точную науку, которая не обходится без статистики.
Раньше семейный доктор знал истории всех своих пациентов наизусть, врач мог всю жизнь прожить в одном городке, найти и запомнить персональный подход к лечению каждого. Тем более, выбор снадобий был невелик: целебные травы, пиявки, ртуть да мышьяк. Ответственности во времена постулата «на все воля Божья» на врачах было поменьше.

Мышьяком с конца XVIII «восстанавливали» потенцию и «лечили» артрит…

… а ртуть, например, была слабительным и «от сифилиса».
Когда медицина стала массовой, у врачей возникла необходимость вырабатывать действительно безошибочные тактики лечения. Определенные лекарства должны были помогать в заданных условиях большинству пациентов.
В идеале, медик должен использовать только те методы профилактики, диагностики и лечения, которые имеют крайне низкую вероятность получения «случайных результатов», потому что полезность и эффективность их доказана многими корректно проведенными экспериментами.
Это и есть доказательная медицина — единственный адекватный на сегодня подход к такому серьезному делу, как здоровье людей.
И именно клинические исследования — основа доказательной медицины.
До середины XX (!) века не было никакого регулирования исследований новых препаратов. Чтобы навести порядок, как часто бывает, понадобилась пара трагедий.
В 1937 умерли 105 детей и один взрослый, принимавшие «эликсир» из антисептика сульфаниламида и… ядовитого диэтиленгликоля. Да, тот, что сегодня используется в антифризе. Тогда фармкомпания
Еще более громкий скандал произошел с талидомидом в конце

Мамы этих детей пили снотворное, не проверенное на людях
С тех пор лекарства перед регистрацией очень тщательно изучают. Регулируется это Международными гармонизированными трехсторонними правилами Надлежащей клинической практики (ICH Harmonized Tripartite Guideline for Good Clinical Practice, сокращённо — ICH GCP). С 1996–97 г. они действуют в США, Японии и ЕС, а с 2003 года введены и в России.
Как проходит исследование и почему так долго?
Весь процесс создания препарата можно поделить на 3 крупных фазы.
- Поиск идеи и доклинические исследования — в пробирках и на животных.
- Если на этом все не закончилось — то начинаются клинические исследования, с людьми: сначала осторожные, потом более массовые.
- Затем препарат регистрируется в регуляторных органах, чтобы стать привычным наименованием в медицинских справочниках.
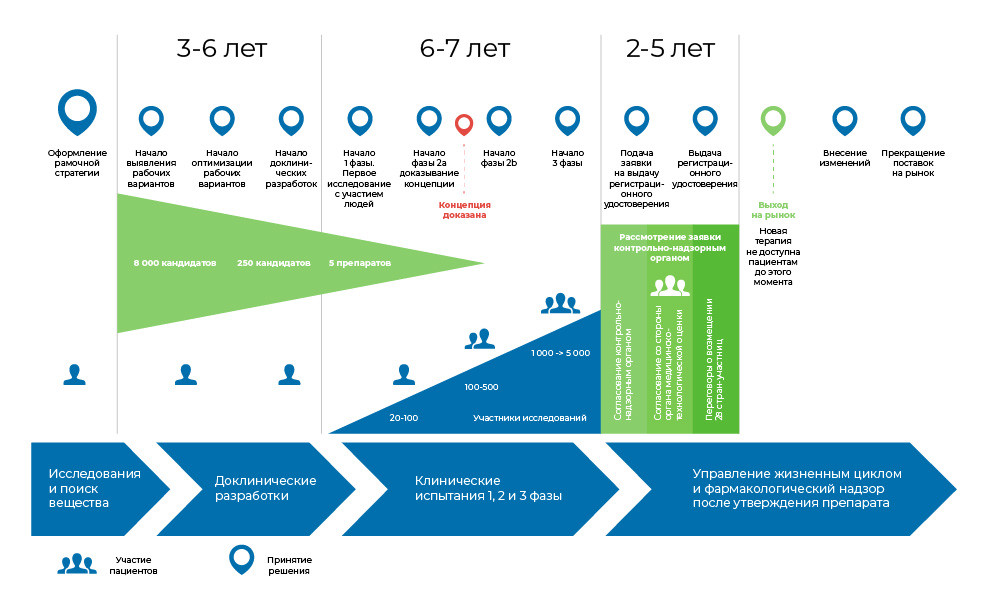
Процесс разработки медицинского препарата. С момента создания молекулы до момента начала продажи лекарства проходит от 8 до 20 лет.
Значит, это
При этом открытия в сфере молекулярной биологии и генетики позволили понять механизмы, которые способствуют развитию и прогрессированию рака, улучшилось понимание работы противоопухолевого иммунитета.
И сегодня разработка противоопухолевых препаратов — одно из самых наукоемких и востребованных направлений медицины.
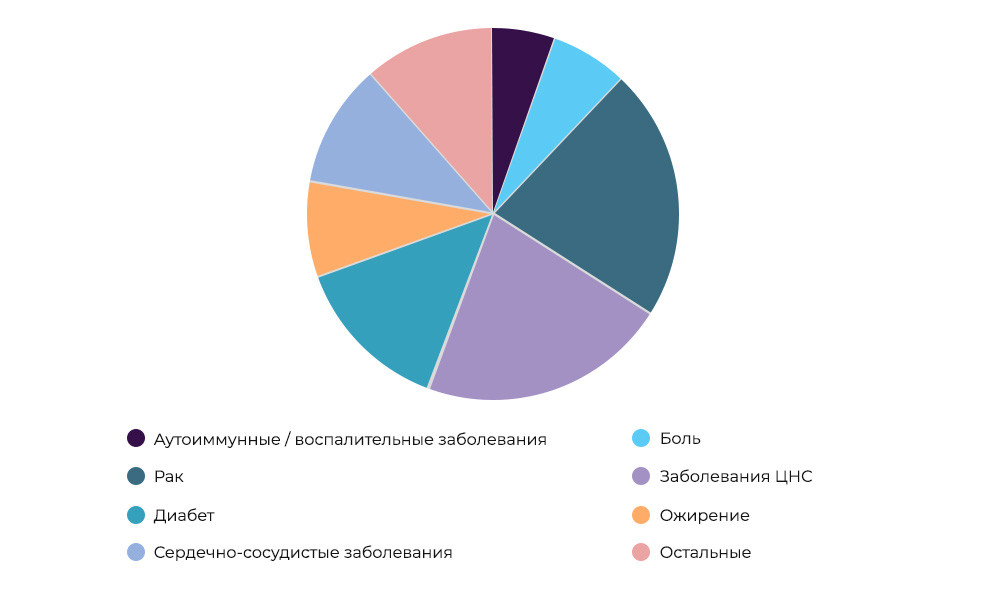
Исследования противораковых препаратов — 23% всех КИ в мире
Кто оплачивает исследования. Иногда организатором и спонсором может стать
Раньше многие фармкомпании проводили исследования самостоятельно, силами своего штата ученых. Сейчас медицинское учреждение, которое прошло аккредитацию и соответствует определенным требованиям, может стать площадкой и исполнителем для эксперимента.
Именно таков случай нашей международной клинике Медика24. Фармкомпания готова платить, но финансы выделяются по окончанию исследования, по факту произведенных расходов.
Сначала появляется идея. Собственно, что исследовать? В онкологии сначала находят «мишени» — слабое место болезни. Если нарушить или просто «выключить» работу
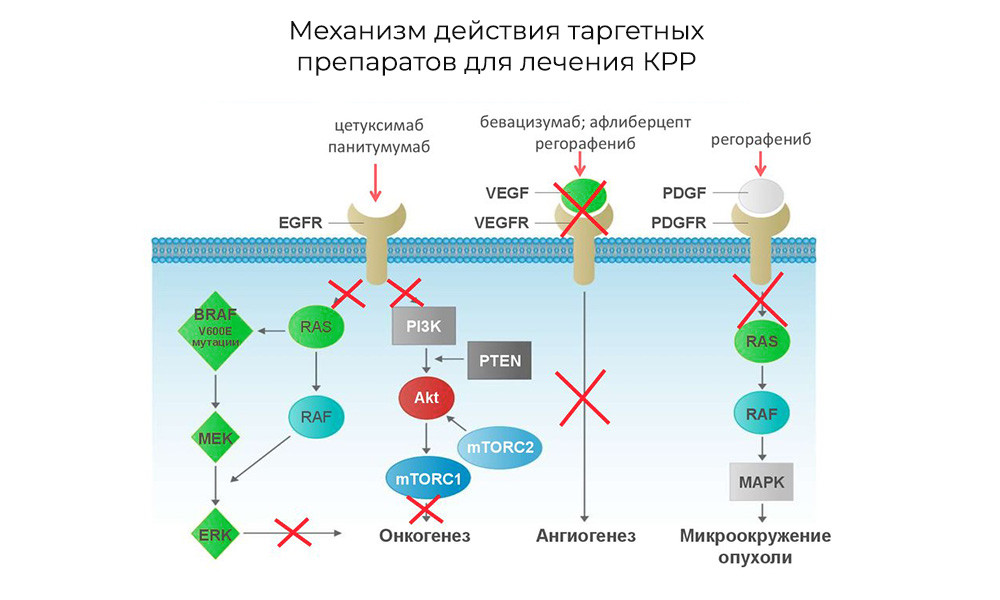
Механизм работы таргетных препаратов при колоректальном раке. Раковые клетки прекращают делиться, либо приращивать к опухоли дополнительные кровеносные сосуды, либо препарат предохраняет соседние клетки от превращения в злокачественные
Чтобы найти такие вещества, а потом выбрать из кандидатов подходящие, требуется много ресурсов и времени на исследования in vitro и in silicio — то есть в пробирке или с помощью компьютерного моделирования.
Выбранное вещество запасают в нужном количестве — производят по специальным правилам (в России это ГОСТ Р 52249–2009), без примесей и нарушения технологии. И с этими пробирками ученые отправляются тестировать препарат на животных.
Мышь — двигатель прогресса. После проверки идей в пробирке ученый с запасом своего потенциального препарата идет в виварий — нужно проверить, как поведет себя прототип в теле млекопитающего (in vivo).
Еще Авиценна в 1025 г. в «Каноне врачебной науки» писал, что лекарства нужно подвергать проверке. Причем, желательно — на потенциальном пациенте, человеке. Ведь результат, полученный на львах и конях, не гарантирует, что на людей лекарство подействует так же.
И до сих пор в медицине без опытов на животных — не обойтись. Львов и коней, правда, оставили в покое. Доклинические исследования во всем мире происходят, в основном, на мышах, морских свинках и кроликах.

Лабораторным мышкам даже поставили памятник в Новосибирском Академгородке
На этом этапе проверяют, насколько вреден/безопасен препарат:
- вызывает ли аллергию,
- оказывает ли токсичное влияние на ткани и органы,
- как влияет на способность животных к размножению и нормальному развитию плода
и т. п.
Кроме того, наблюдают, как кандидат в лекарства ведет себя внутри организма зверька (фармакокинетика):
- скорость всасывания и нарастание концентрации в крови,
- каковы максимальная и минимальная доза,
- как быстро выводится из организма,
и т. п.
Все эти данные нужны, чтобы решить: можно ли применять исследуемое вещество для людей. И если да — то сколько его нужно.
Неизбежное зло. Бюрократия. За правильным ходом КИ следят Департамент гос. регулирования обращения лекарственных средств Минздрава и Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор).
Если ученый пришел к моменту, когда нужно переходить к клиническим исследованиям на людях — пора готовить заявку на проведение КИ. Для этого ему нужно несколько документов.
- Досье исследуемого лекарственного препарата. Все, что уже выяснили о препарате: данные о фармакокинетике, эффективности, токсичности
и т. п. - Протокол исследования. В нем подробно описан план будущего исследования и методики оценки результатов;
- Брошюра исследователя. Краткая шпаргалка, чтобы понятно объяснить суть исследования волонтерам и пациентам и получить их информированное согласие.
Этический комитет. Следующий этап квеста — получить оценку и заключение комитета по этике.
Комитет по этике — это независимая группа врачей, ученых, медицинского персонала и неспециалистов (представителей общественности). Они изучают протокол исследования и информированное согласие, чтобы до старта исследования удостовериться, что между пациентом, исследователями, фармкомпанией и национальным компетентным органом регулирования достигнуто согласие, ничьи права не нарушены, никто не подвергается принуждению и никому не прищемили свободу воли.
После тяжелых побочных эффектов от одного препарата в 2006 г., этический комитет стал еще строже. Поэтому иногда исследование может «зависнуть» на этом этапе на год и более.
После проверки всех документов и одобрения этического комитета потенциальный препарат переходит в стадию клинических испытаний — на людях.
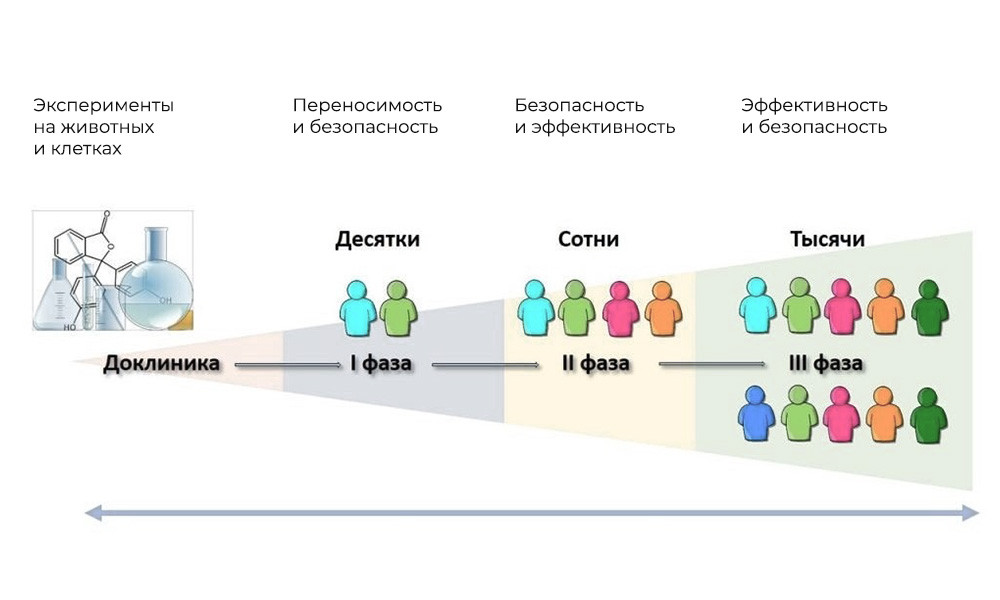
Основные фазы клинических исследований — на людях
Фаза I. Проверка механизма действия
Участники: 20 — 100 человек.
Длительность: от нескольких месяцев до 1 года.
Цель: изучить переносимость, фармакодинамику и фармакокинетику.
Проверяется, действует ли вещество на людей так же, как на животных, безопасно ли оно.
В первой фазе клинического исследования должны, теоретически, участвовать здоровые добровольцы, но в онкологии тестирование сильнодействующих веществ на здоровом организме нельзя назвать этичным. Поэтому участвуют люди с соответствующим заболеванием, против которого может быть эффективен будущий препарат.
Участникам постепенно вводят все бОльшие дозы препарата, начиная с минимальной и до максимально допустимой. После каждого введения отслеживается состояние пациента.
Оценивают фармакокинетику: скорость всасывания и экскреция (выделение неизменённого вещества), распределение по тканям и органам. Также оценивается фармакодинамика: действие препарата на клетки опухоли, на другие такни и органы, побочные эффекты. Выясняется предпочтительный вариант применения и уровень дозировки.
Кроме исследований с нарастающими дозами, в фазе I проверяют:
- действие пищи на препарат;
- взаимодействие с другими препаратами;
- влияние прочих заболеваний, которые могут повлиять на нужные дозы препарата (например, у пациента с почечной недостаточностью).
По данным FDA, первую фазу КИ успешно проходят 70% препаратов.
Фаза II. Проверка действия на заданную цель: конкретный вид заболевания
Участники: 100 — 500 пациентов.
Длительность: от нескольких месяцев до 2 лет.
Цель: проверка эффективности при определенных показаниях
Необходимо изучить, насколько новый препарат эффективнее по сравнению с плацебо или уже существующим лечением. Плюс, большее количество участников позволяет обнаружить более редкие побочные эффекты, которые не выявлены в фазе I.
Для участия в этой фазе КИ пациенты отбираются по гораздо большему количеству критериев, чем в первую фазу. Например, не просто «рак молочной железы», а «рак молочной железы, стадия T2N1M0,
Обычно на этой стадии исследования проводятся как двойные слепые рандомизированные
Двойное ослепление: ни врач, ни пациент не знают, кто получает активное вещество, а кто — плацебо или оптимальное существующее на данный момент лечение.
Рандомизация подразумевает, что пациенты делятся на группы случайным образом — с помощью генератора случайных чисел. Повлиять на этот процесс не может ни врач, ни участник КИ.
Всем — одинаковые на вид, вкус и запах лекарства.
Вся эта «конспирология» нужна, чтобы исключить умышленное или неосознанное искажение данных эксперимента участниками или исследователями.
Так, в первой фазе, где нет таких жестких требований, бывают ошеломительные результаты. Это «грязная» статистика, в фазе II она очищается от лишнего и результаты становятся правдоподобными.
Согласно данным FDA, лишь 33% препаратов, дошедших до фазы II, успешно проходят КИ и переходят в следующую фазу.
Фаза III. Подтверждающие исследования
Количество участников: 300 — 3 000 и более.
Продолжительность: от года до нескольких лет.
Цель: подтверждение эффективности и безопасности исследуемого вещества на больших выборках.
Это самая крупномасштабная, сложная и дорогостоящая часть процесса разработки препарата. Цель таких исследований — подтвердить эффективность и безопасность исследуемого вещества при применении большим количеством пациентов.
По результатам этой фазы производители препарата получают разрешение для вывода его на рынок.
В фазе III могут принимать участие тысячи пациентов из разных стран. Все должно быть спланировано до мелочей, чтобы во всех местах проведения исследования его дизайн и значимые условия были абсолютно одинаковыми.
Дизайн исследования настолько узкий, что в него может попасть не только умирающий, но и пациент с прогнозом на стойкую ремиссию. Препарат должен быть настолько безопасным, чтобы его можно было давать практически здоровому человеку — и качество жизни не снижалось.
Перед началом фазы III проводится множество консилиумов и обсуждений между исследователями и сторонними экспертами: очень важно продумать дизайн экспериментов так, чтобы не упустить важное и получить все нужные данные.
В ходе фазы III окончательно подтверждается эффективность и безопасность нового лекарства, зависимость эффекта от дозы.
Анализируется соотношение преимуществ и рисков. По результатам контролирующий орган принимает решение о том, можно ли выводить препарат на рынок. Для этого нужно, чтобы соблюдались условия:
- препарат более эффективен, чем ранее известные аналоги,
- дает меньше побочных эффектов/лучше переносится,
- эффективен, когда не работают ранее известные препараты,
- более выгоден экономически,
- проще в применении.
Процесс рассмотрения заявки надзорным органом занимает 12–18 месяцев.
По данным FDA, третья фаза клинических исследований заканчивается положительным результатом лишь в 25–30% случаев от всех, что были на старте третьей фазы.
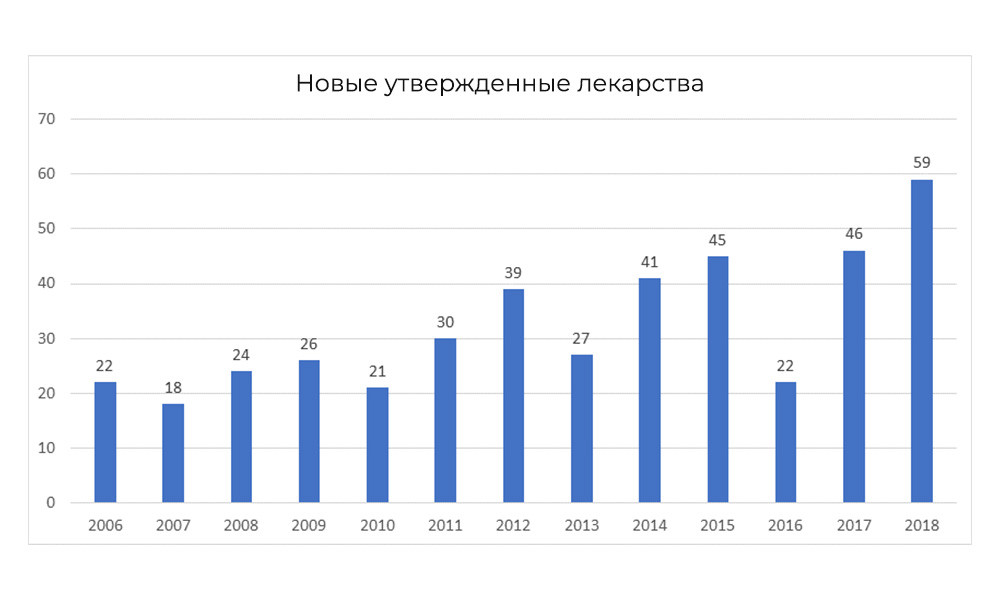
Тем не менее, в 2018 FDA побила собственный рекорд по числу одобренных препаратов
Особенности национальных исследований: дополнительный этап КИ в России
У контроля за новыми препаратами в России есть свои баги (или фичи, как посмотреть). По закону, одобренные зарубежные препараты должны пройти дополнительные клинические испытания в России: якобы, это повысит качество зарубежных препаратов.
Когда препарат уже прошел 3 фазы, вышел в продажу на мировой рынок, в нашей стране он еще может быть не зарегистрирован. Мы знаем, что он работает, в его инструкции на иностранных языках есть показания, подтвержденные 3 фазами исследований в США, или Канаде, или Европе.
Скажем, 12 показаний — 12 диагнозов, при которых препарат будет эффективен. Но в России еще не все эти показания подтвердили официально, только 6 из 12. И если у пациента именно тот вид рака, для лечения которого препарат еще пока официально не зарегистрирован в РФ, такой препарат бесплатно, в рамках ОМС, он не получит.
Это на 2–3 года замедляет пациентам доступ к новым лекарствам.
Международная клиника Медика24 участвует в исследованиях фазы III.
Так мы вносим вклад в ускорение процесса регистрации препаратов. Чем быстрее у фармацевтических компаний окажутся данные по необходимому количеству пациентов, тем быстрее лекарство «примут на вооружение». Сначала во всем мире, затем и у нас. В итоге мы влияем на то, чтобы его смогли получать все — не только в частных клиниках, но и в любом государственном онкодиспансере, по ОМС.
К тому же, для наших пациентов участие в клинических исследованиях III фазы — это возможность получить уже достаточно проверенное и безопасное новое лечение- без нескольких лет ожидания, пока оно официально «доберется» до России.
К сожалению, нас таких мало. Не всякая клиника может принимать у себя КИ.

Для разных препаратов — разные холодильники
Словом, те клиники и врачи, которые хотят этим заниматься, должны еще постараться, чтобы создать определенные условия.
Как происходит исследование
К нам в атмосфере полной секретности привозят само вещество и толстую папку на 1 200 листов, где прописан дизайн и протокол исследования. Там указана каждая мелочь: как, в какое время и в каких дозах мы должны вводить препарат, как часто и в каком количестве брать кровь на анализ, какие анализы проводить, как часто делать МРТ и КТ. Сколько раз в день и в какой форме отправлять «шифровки в центр» — отчеты
Набираем 2 или 3 группы пациентов, подписываем с ними информированное согласие.
Обычно на участие в клинических исследованиях люди соглашаются по 2 причинам:
- отсутствие эффективных методов лечения их болезни,
- желание сделать вклад в развитие науки.
В любом случае это исключительно добровольное решение. Исследователи обязаны в письменном виде предоставить пациенту информацию о цели КИ, о том, как оно будет проводиться, какое лекарство будет применяться,
Наши пациенты пока ни разу не отказывались — для них это невероятный шанс получить лечение, причем бесплатное, когда остальные методы терапии уже исчерпали себя.
Конечно, всех подряд взять в исследование не получится. Требования даются «сверху», и это очень узкий набор параметров: сколько должно быть лет участникам, какой точный диагноз, были/не было операций, уровень креатинина и железа в крови — до знака после запятой.
Но онкологических пациентов у нас много. Если клиент признается, что денег на лечение нет — мы обязательно проверяем требования к участникам исследования. Вполне возможно, что ему найдется место.
В данный момент открыт набор в 18 крупномасштабных исследований.
Конечно, масштабы в частной клинике — совсем не то, что в большом НИИ, но обычно 3–4 пациента в неделю попадают в протокол исследования. Это немало: не менее 10 человек в месяц, которые получают самое продвинутое передовое лечение — бесплатно.
И у них самих появляется дополнительный шанс, и будущие пациенты скорее смогут получить этот препарат, когда закончится КИ.
Пациенты вовсе не обязательно постоянно находятся в клинике — если это не запрещено дизайном КИ и пациент чувствует себя хорошо — он участвует амбулаторно. Приходит, получает свою капельницу и уходит. Есть и такие, кому лучше остаться в клинике, под присмотром.
В результате долгих месяцев скрупулезного выполнения длинного списка требований, постоянного мониторинга состояния пациента, консолидации данных по десяткам параметров мы делаем исследования, которые будут опубликованы, а пользоваться результатами — расширенной возможностью применения новых препаратов — будут все врачи из всех онкоцентров страны. И несколько десятков человек получают шанс на лечение прямо сейчас.
Надеемся, этот текст был для вас просто интересным чтением.
Но если тема касается вас близко — загляните в списки клинических исследований на RosOncoWeb, CTAgency и на сайте Минздрава. И обязательно свяжитесь с онкологами международной клиники Медика24 — шансом нужно воспользоваться.
Материал подготовлен кандидатом медицинских наук, врачом-онкологом, заместителем главного врача по лечебной работе международной клиники Медика24 Сергеевым Петром Сергеевичем по материалам открытых источников.
Содержание
- Грустные истории. Зачем нужны клинические испытания и почему без них — плохо
- Как проходит исследование и почему так долго?
- Фаза I. Проверка механизма действия
- Фаза II. Проверка действия на заданную цель: конкретный вид заболевания
- Фаза III. Подтверждающие исследования
- Особенности национальных исследований: дополнительный этап КИ в России
- Как происходит исследование
ПОПУЛЯРНОЕ
- Вскрытие паратонзиллярного абсцесса
- Дренирование желчных протоков при механической желтухе
- Осмотр под лампой Вуда
- Оментэктомия (удаление большого сальника)
- Рассечение девственной плевы
- Эпицистостомия
- Аппендэктомия
- Удаление инородного тела из влагалища
- Установка колостомы
- Химиотерапия при раке с метастазами
